En esta ocasión queremos comentarte sobre el número atómico, su significado y la vinculación que tiene con la masa atómica. Igualmente tienes que saber que no todos los elementos forman parte de la biosfera poseen el mismo número atómico, por lo que te invitamos a seguir leyendo
El número atómico
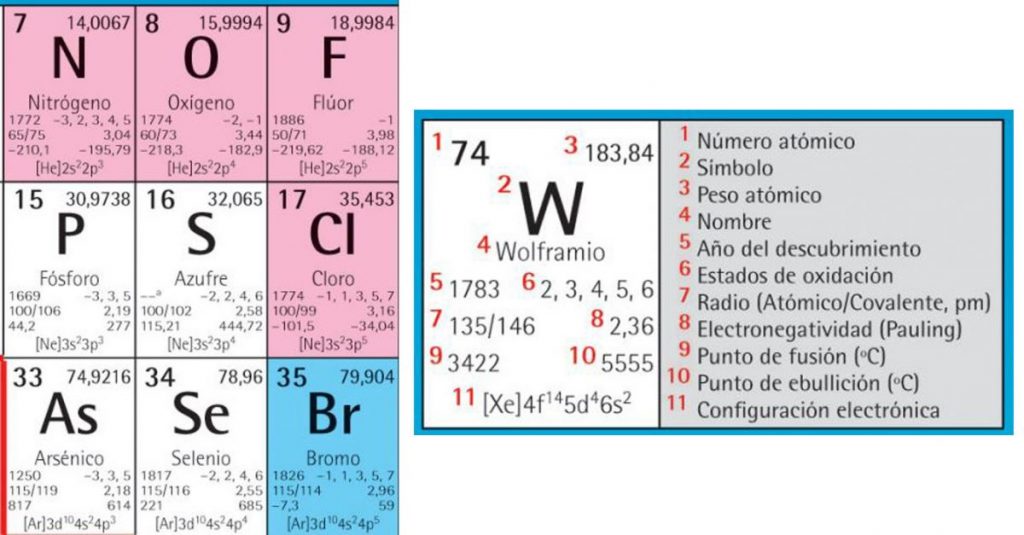
En la química y en la física, el número atómico tiene una aplicación práctica, porque a través de él, es posible conocer el número total de protones que forman parte del núcleo atómico de un elemento químico en particular.
Lo usual es que se identifique con la letra Z, que es sacado de la palabra en alemán zahl, que quiere decir número, y lo normal es que se coloque como un subíndice a la izquierda del símbolo químico del elemento de que se trate, justo abajo del número másico (A). Te lo mostramos con el siguiente ejemplo:
2311Na: elemento: sodio, número atómico: 11, y número másico: 23.
Todo átomo está conformado de partículas subatómicas, varias de las cuales están contenidas en su núcleo, compuestos por neutrones y protones mientras que otras se encuentran girando en espiral alrededor del núcleo, que se componen de electrones. Las primeras estructuras tienen una carga positiva, por tener protones, o neutra por estar compuesta de neutrones y las últimas poseen una carga negativa porque están compuestas de electrones.
Debido a que en la naturaleza los átomos son eléctricamente neutrales lo que nos podría llevar a pensar que sólo tienen neutrones, pero esto no es así, no quiere decir que no poseen protones y electrones, el contrario, si los tienen pero en igual número, para que se anulen entre sí. De manera que si un átomo posee Z = 11, tendrá no sólo once protones, sino que también tiene 11 electrones a su alrededor.
Igualmente, el número atómico es lo que ha permitido ordenar los elementos que se conocen de la Tabla Periódica, ya que la forma de hacerlo es que va del menor al mayor número de protones en el núcleo. Así, tenemos que el hidrógeno (H) tiene apenas un protón (Z = 1), mientras que el oganesón (Og) posee ciento dieciocho (Z = 118). De esa manera es posible establecer una diferencia entre los elementos de poco peso de los que sean más pesados.
La tabla periódica y el número atómico
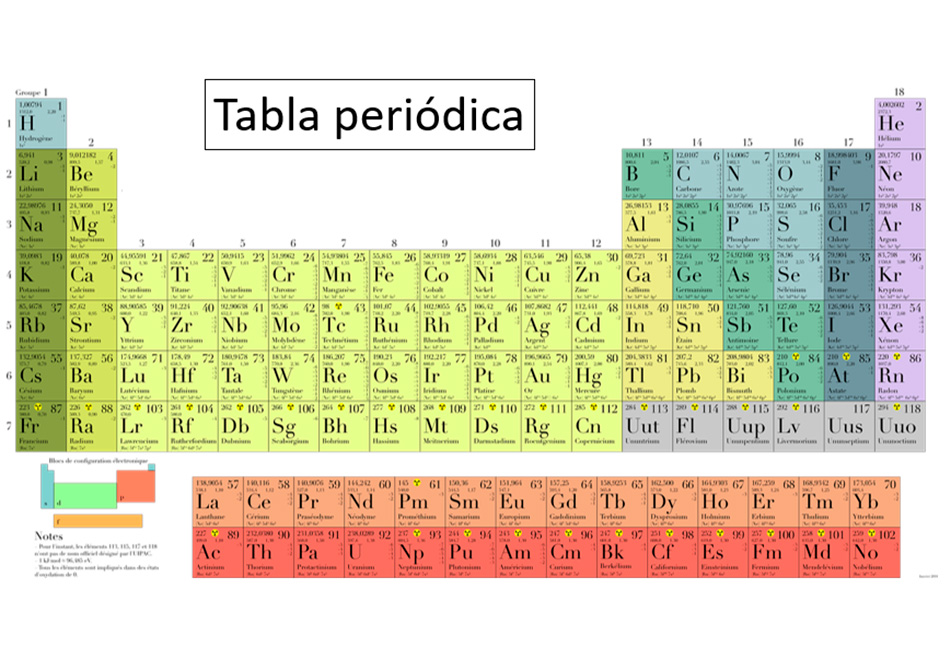
Estos son los números atómicos de la Tabla Periódica completa:
Hidrógeno (H): Z = 1 Helio (He): Z = 2
Litio (Li): Z = 3 Berilio (Be): Z = 4
Boro (B): Z = 5 Carbono (C): Z = 6
Nitrógeno (N): Z = 7 Oxígeno (O): Z = 8
Flúor (F): Z = 9 Neón (Ne): Z = 10
Sodio (Na): Z = 11 Magnesio (Mg): Z = 12
Aluminio (Al): Z = 13 Silicio (Si): Z = 14
Fósforo (P): Z = 15 Azufre (S): Z = 16
Cloro (Cl): Z = 17 Argón (Ar): Z = 18
Potasio (K): Z = 19 Calcio (Ca): Z = 20
Escandio (Sc): Z = 21 Titanio (Ti): Z = 22
Vanadio (V): Z = 23 Cromo (Cr): Z = 24
Manganeso (Mn): Z = 25 Hierro (Fe): Z = 26
Cobalto (Co): Z = 27 Níquel (Ni): Z = 28
Cobre (Cu): Z = 29 Zinc (Zn): Z = 30
Galio (Ga): Z = 31 Germanio (Ge): Z = 32
Arsénico (As): Z = 33 Selenio (Se): Z = 34
Bromo (Br): Z = 35 Kriptón (Kr): Z = 36
Rubidio (Rb): Z = 37 Estroncio (Sr): Z = 38
Itrio (Y): Z = 39 Zirconio (Zr): Z = 40
Niobio (Ni): Z = 41 Molibdeno (Mb): Z = 42
Tecnecio (Tc): Z = 43 Rutenio (Ru): Z = 44
Rodio (Rh): Z = 45 Paladio (Pd): Z = 46
Plata (Ag): Z = 47 Cadmio (Cd): Z = 48
Indio (In): Z = 49 Estaño (Sn): Z = 50
Antimonio (Sb): Z = 51 Telurio (Te): Z = 52
Yodo (I): Z = 53 Xenón (Xe): Z = 54
Cesio (Cs): Z = 55 Bario (Ba): Z = 56
Lantano (La): Z = 57 Cerio (Ce): Z = 58
Praseodimio (Pr): Z = 59 Neodimio (Nd): Z = 60
Prometio (Pr): Z = 61 Samario (Sm): Z = 62
Europio (Eu): Z = 63 Gadolinio (Gd): Z = 64
Terbio (Tb): Z = 65 Disprosio (Dy): Z = 66
Holmio (Ho): Z = 67 Erbio (Er): Z = 68
Tulio (Tm): Z = 69 Iterbio (Yb): Z = 70
Lutecio (Lu): Z = 71 Hafnio (Hf): Z = 72
Tantalio (Ta): Z = 73 Wolframio (W): Z = 74
Renio (Re): Z = 75 Osmio (Os): Z = 76
Iridio (Ir): Z = 77 Platino (Pt): Z = 78
Oro (Au): Z = 79 Mercurio (Hg): Z = 80
Talio (Tl): Z = 81 Plomo (Pb): Z = 82
Bismuto (Bi): Z = 83 Polonio (Po): Z = 84
Ástato (At): Z = 85 Radón (Rn): Z = 86
Francio (Fr): Z = 87 Radio (Ra): Z = 88
Actinio (Ac): Z = 89 Torio (Th): Z = 90
Proactinio (Pa): Z = 91 Uranio (U): Z = 92
Neptunio (Np): Z = 93 Plutonio (Pu): Z = 94
Americio (Am): Z = 95 Curio (Cm): Z = 96
Berkelio (Bk): Z = 97 Californio (Cf): Z = 98
Einstenio (Es): Z = 99 Fermio (Fm): Z = 100
Mendelevio (Md): Z = 101 Nobelio (No): Z = 102
Laurencio (Lr): Z = 103 Rutherfordio (Rf): Z = 104
Dubnio (Db): Z = 105 Seaborgio (Sg): Z = 106
Bohrio (Bh): Z = 107 Hasio (Hs): Z = 108
Meitnerio (Mt): Z = 109 Darmstatio (Ds): Z = 110
Roentgenio (Rg): Z = 111 Copernicio (Cn): Z = 112
Nihomio (Nh): Z = 113 Flerovio (Fl): Z = 114
Moscovio (Mc): Z = 115 Livermorio (Lv): Z = 116
Teneso (Ts): Z = 117 Oganesón (Og): Z = 118
Número másico y masa atómica
En la tabla periódica también se identifica la masa atómica del isótopo más estable del elemento de que se trate. El número másico resulta de sumar los protones y los neutrones. Se identifica con la letra A, que deriva de la palabra alemana Atomgewicht y que, tal como hemos indicado antes, aparece como un índice a la izquierda del símbolo químico, para ponerte un ejemplo: 23Na.
Lo normal es que el número másico sea alrededor del doble que el número atómico de un elemento químico, ya que los neutrones son los que determinan la estabilidad del núcleo atómico, logrando superar que sean repelidos, como naturalmente ocurre, los protones que tienen cargas positivas. Además, el número másico varía en cada isótopo, lo que lo diferencia del número atómico.
¿Cómo se calcula el número másico?

El número másico se puede calcular de acuerdo a la siguiente fórmula:
Número másico (A) = Número atómico (Z) + número de neutrones (N).
Pero, no hay que confundir el número másico con la masa atómica. La masa atómica es algo que se mide en unidades u o Da. Esta unidad se computa partiendo del átomo de carbono y cada u constituye una doceava parte de la masa del mismo.

