Un tampón o buffer es una solución acuosa que puede resistir cambios significativos en los niveles de pH tras la adición de una pequeña cantidad de ácido o álcali.
UTILIDAD DEL BUFFER
Cada buffer se caracteriza por una «capacidad» establecida que se define como la cantidad de ácido o base fuerte que se debe agregar para cambiar el pH de un litro de solución en una unidad de pH. En otras palabras, la capacidad buffer es la cantidad de ácido o base que se puede agregar antes de que el pH comience a cambiar significativamente.
Un rango de buffer o tapón es el rango de pH específico en el que un tampón neutraliza efectivamente el ácido o la base añadidos, mientras mantiene un pH casi constante.
La capacidad y el rango de un búfer particular asegura que la pequeña cantidad agregada de ácido / base se neutralice y la reacción química continúe sin dar un resultado incorrecto para el experimento / proceso. En pocas palabras, un tampón o buffer es una mezcla de un ácido débil y su base conjugada o una base débil y su ácido conjugado.
HAY DOS TIPOS DE SOLUCIONES BUFFER
Tampón ácido
Las soluciones buffer ácidas tienen un pH inferior a 7. Por lo general, están hechas de un ácido débil y una de sus sales (a menudo llamado conjugado).
Las soluciones ácidas comúnmente utilizadas son una mezcla de ácido etanoico y etanoato de sodio en solución, que tienen un pH de 4,76 cuando se mezclan en concentraciones molares iguales. Puede cambiar el pH de la solución buffer cambiando la proporción de ácido a sal, o eligiendo un ácido diferente y una de sus sales.
Buffer alcalino
Las soluciones alcalinas tienen un pH superior a 7 y están hechas de una base débil y una de sus sales. Un ejemplo muy común de solución alcalina es una mezcla de amoníaco y solución de cloruro de amonio. Si estos se mezclaran en proporciones molares iguales, la solución tendría un pH de 9,25.
¿CÓMO FUNCIONAN LOS BÚFERES?
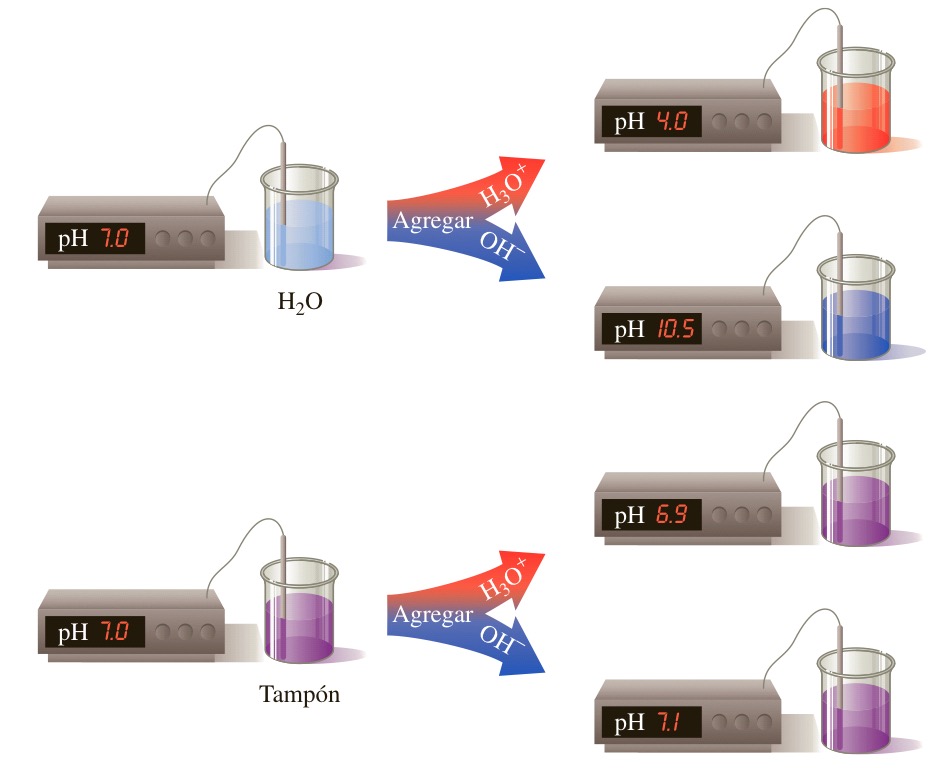
Funcionan neutralizando cualquier ácido (iones H +) o base (iones OH-) añadido para mantener el pH moderado, lo que los convierte en un ácido o base más débil.
Tomemos un ejemplo de un buffer compuesto por amoniaco de base débil, NH2, y su ácido conjugado, NH4 +. Cuando se agrega HCl (ácido fuerte) a este sistema buffer, los iones H + adicionales agregados al sistema son consumidos por el NH2 para formar NH4 +.
Ahora, debido a que todos los iones H + adicionales están bloqueados y han formado un ácido más débil, NH4 +, el pH del sistema no cambia significativamente. De manera similar, cuando se agrega NaOH (base fuerte) a este sistema buffer, el ion amonio dona un protón a la base para convertirse en amoníaco y agua, neutralizando así la base sin ningún cambio significativo de pH.
Ahora bien, hay un término que llamamos, «ruptura de la solución buffer» que surge cuando la base completa y su ácido conjugado (en el caso anterior NH2 y NH4 +) se consumen para neutralizar el ácido o la base añadidos.
La adición adicional de un ácido o una base al tampón cambiará su pH rápidamente. Por tanto, la ruptura del tampón es su capacidad, o en otras palabras, es la cantidad de ácido o base que un tampón puede absorber antes de romper su capacidad.
Cabe señalar que una solución con una base débil tiene una mayor capacidad buffer para la adición de un ácido fuerte y una solución de ácido débil tiene una mayor capacidad para la adición de una base fuerte.
NOTA ADICIONAL
Un ácido conjugado es una especie formada por la ganancia de un protón por una base, mientras que a la inversa, una base conjugada es una especie formada por la eliminación de un protón de un ácido.
Podemos entender esto por la siguiente ecuación:
Ácido + Base ⇌ Base conjugada + Ácido conjugado
H2O (l) + NH2 (g) → OH− (aq) + NH4 + (aq)
En esta ecuación, H2O es el ácido conjugado y su base conjugada correspondiente es OH−, mientras que NH2 y NH4 + representan la base y su par ácido conjugado. Aquí debe notarse que cuanto más fuerte es el ácido o la base, más débil es el conjugado y cuanto más débil es el ácido o la base, más fuerte es el conjugado.

¿Qué crees que pasará si el pH de nuestra sangre cambia drásticamente desde su pH normal de 7,35?
Sí, las células de nuestro cuerpo no funcionarán correctamente y nuestros sistemas corporales fallarán. La sangre humana contiene un «buffer» que le permite mantener su pH en 7,35 para asegurar la función celular normal. Las soluciones buffer también son importantes en los procesos químicos y bioquímicos donde el control del pH es muy importante. Es importante que entendamos los búferes con más detalle.

